Der Vertrieb des Pfizer-BioNTech-Coronavirus-Impfstoffs in den USA kann beginnen, wobei zuerst Beschäftigte im Gesundheitswesen und Bewohner der Langzeitpflege geimpft werden müssen.
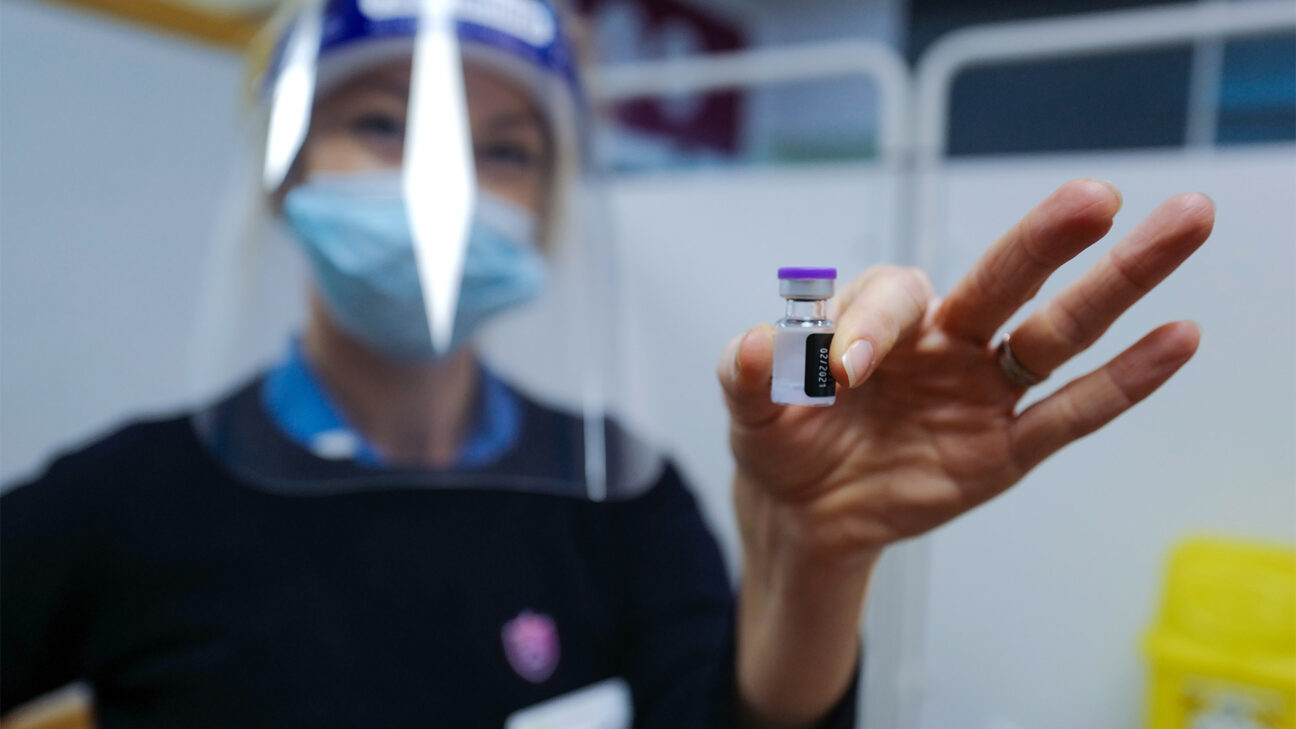
Der Pfizer-BioNTech-Coronavirus-Impfstoff wurde am Freitag von der Food and Drug Administration FDA für die Anwendung bei Personen ab 16 Jahren im Notfall zugelassen.
Die Zulassung macht es zum ersten Impfstoff, der diesen Meilenstein in den USA erreicht hat.
Dies öffnet den Mitarbeitern des Gesundheitswesens und den Bewohnern der Langzeitpflege die Tür, Anfang nächster Woche die ersten Dosen des Impfstoffs zu erhalten.
Die Notfallzulassung des Impfstoffs bietet den Vereinigten Staaten ein weiteres Instrument zur Umkehrung des Anstiegs von COVID-19-Fällen und Todesfällen.
Das COVID-Tracking-Projekt, das Coronavirus-Daten auf Bundesstaatsebene überwacht, wurde gemeldet. 3.067 COVID-19-Todesfälle am Donnerstag. Dies ist die höchste 1-Tages-Maut des Landes seit Beginn der Pandemie.
Bisher mehr als 294.000 Menschen sind in den USA an COVID-19 gestorben.
Außerdem könnten viele Menschen, auch diejenigen, die am Anfang nur eine leichte Krankheit hatten, eine nehmen Jahr oder länger, um sich vollständig zu erholen sagen einige Experten.
Bei diesen COVID-19-Langstreckenfahrern treten anhaltende Symptome wie Müdigkeit, Atemnot und Gehirnnebel auf.
Obwohl die Zulassung des Impfstoffs einen wichtigen Meilenstein im Kampf der Vereinigten Staaten gegen die Pandemie darstellt, wird die Einführung des Impfstoffs voraussichtlich Monate dauern, wobei die Dosen zu Beginn begrenzt sind.
Andererseits haben die klinischen Phase-3-Studien nicht gezeigt, ob der Impfstoff eine asymptomatische Infektion verhindern oder Menschen davon abhalten kann, das Virus auf andere zu übertragen.
Daher sind bis weit in das nächste Jahr hinein vorbeugende Maßnahmen wie das Tragen von Masken und die körperliche Distanzierung erforderlich, um die Ausbreitung des Virus zu verlangsamen und dem Land die Wiederaufnahme seiner normalen Aktivitäten zu ermöglichen.
Mit der Notfallgenehmigung beginnt die harte Arbeit, den Impfstoff an diejenigen zu bringen, die ihn am dringendsten benötigen.
Viele Gesundheitsexperten betonen, dass Impfstoffe kein Leben retten - Impfungen schon.
Bis Ende dieses Monats werden in den USA 6,4 Millionen Dosen des Pfizer-BioNTech-Impfstoffs erhältlich sein. laut Bundesbeamten .
Etwa die Hälfte dieser Dosen wird innerhalb von 24 Stunden nach der Notfallgenehmigung der FDA in die Staaten verschickt. Der Rest wird später verteilt, wenn die ersten Empfänger etwa 3 Wochen später ihre zweite Dosis erhalten sollen.
Die Vorbereitungen für die Verteilung begannen vor Monaten mit der Koordination zwischen Gesundheitsbehörden des Bundes und der örtlichen Behörden sowie mit Gesundheitssystemen und Apothekenketten.
Die Erst- und Nachdosierung in die Arme der Menschen zu bringen, wird dadurch erschwert, dass der Impfstoff bei extrem niedrigen Temperaturen -80 ° C in Gefrierschränken gelagert werden muss.
Dies bedeutet, dass nur wenige Einrichtungen den Impfstoff handhaben und verteilen können.
Zusätzlich die Mindestbestellmenge Der Impfstoff enthält 975 Dosen, was eine Herausforderung für Gebiete darstellen kann, in denen nicht so viele Menschen mit hohem Risiko geimpft werden müssen.
Ein beratender Ausschuss für die Zentren für die Kontrolle und Prävention von Krankheiten CDC stimmte letzte Woche dafür empfehlen dass Beschäftigte im Gesundheitswesen und Bewohner von Pflegeheimen und anderen Langzeitpflegeeinrichtungen an erster Stelle stehen, um den Impfstoff zu erhalten.
Staaten sind nicht verpflichtet, der Empfehlung der CDC zu folgen, aber viele haben angegeben, dass sie dies tun werden.
Wenn mehr Dosen des Impfstoffs verfügbar werden, können andere Gruppen mit hoher Priorität geimpft werden.
Als nächstes werden wahrscheinlich Polizisten, Feuerwehrleute, Arbeiter in der Lebensmittel- und Landwirtschaft sowie andere wichtige Arbeiter hinzukommen. Sie werden von Menschen mit zugrunde liegenden Gesundheitszuständen verfolgt, die ihr Risiko für schweres COVID-19 erhöhen.
Die USA haben laut Pfizer-BioNTech genug Impfstoff bestellt, um 50 Millionen Menschen zu impfen. Forbes .
Im Laufe des Sommers gab die Trump-Administration die Möglichkeit weiter, zusätzliche Dosen gemäß a zu sichern. New York Times Bericht.
Dies könnte dazu führen, dass die USA hinter anderen Ländern, die den Impfstoff ebenfalls vorbestellt haben, in der Schlange stehen.
Die Trump-Administration hat Verträge mit fünf anderen Impfstoffkandidaten.
Eines davon ist Moderna's, das die FDA voraussichtlich noch in diesem Monat für den Notfall verwenden wird. Das Beratungsgremium der FDA tritt am zusammen.
Moderna war Teil des Operation Warp Speed-Programms der US-Bundesregierung, eines milliardenschweren Programms zur Beschleunigung der Entwicklung eines Coronavirus-Impfstoffs.
Pfizer entschied sich für den Alleingang und erhielt keine US-Mittel, um den Impfstoff zu entwickeln.
Die Notfallgenehmigung erfolgt nach einem Treffen eines unabhängigen Beratungsausschusses am Donnerstag, um Daten aus der Phase-3-Studie von Pfizer-BioNTech zu erörtern.
Die FDA sollte am Samstagmorgen eine Entscheidung treffen.
Aber am Freitag zuvor hatte Mark Meadows, Stabschef des Weißen Hauses, FDA-Kommissar Dr. Stephen Hahn gebeten, seinen Rücktritt einzureichen, falls der Impfstoff bis Ende Freitag nicht zugelassen wurde. Die Washington Post gemeldet.
Hahn sagte später, die Geschichte sei nicht wahr.
„Dies ist eine unwahre Darstellung des Telefongesprächs mit dem Stabschef“, sagte Hahn in einer an die Post gesendeten Erklärung. „Die FDA wurde ermutigt, die EUA-Anfrage von Pfizer-BioNTech zügig weiter zu bearbeiten. Die FDA hat sich zur Herausgabe verpflichtetdiese Genehmigung schnell, wie wir heute Morgen in unserer Erklärung festgestellt haben. ”
Der Beirat, der sich aus unabhängigen wissenschaftlichen Experten, Ärzten für Infektionskrankheiten und Statistikern zusammensetzt, stimmte mit 17 zu 4 für die Dringlichkeitsgenehmigung. Die Abstimmung hatte eine Enthaltung.
Die FDA ist zwar nicht verpflichtet, der Empfehlung des Beirats zu folgen, tut dies jedoch im Allgemeinen.
Meadows 'Aussage markiert eine weitere Salve im andauernden Kampf zwischen Präsident Donald Trump - der lange auf die Zulassung eines Coronavirus-Impfstoffs vor dem Wahltag drängte - und Hahn von der FDA, der sich für die Einhaltung der hohen Standards der Agentur für Arzneimittelprüfungen eingesetzt hat.
Die Zulassung markiert einen bedeutenden Meilenstein. Die Arbeit an Impfstoffen zum Schutz vor SARS-CoV-2 dem Virus, das COVID-19 verursacht begann vor 11 Monaten, nachdem chinesische Forscher das Genom des Virus sequenziert hatten.
Während einige Leute Bedenken geäußert haben, dass die Impfstoffentwicklung beschleunigt wurde, war der Prozess unterstützt durch einen Mittelzufluss und eine Straffung der Regulierungsprozesse.
Darüber hinaus ermöglichten die vielen Coronavirus-Hotspots in den USA und anderen Ländern Pfizer, Fälle von COVID-19 schneller zu akkumulieren, um die Ziele der Studie zu erreichen.
Dr. Peter Hotez , PhD, Professor und Dekan der National School of Tropical Medicine am Baylor College of Medicine in Houston, sagte in einem Interview mit MSNBC begann die Entwicklung des Coronavirus-Impfstoffs bereits vor dem Auftreten von COVID-19.
„Manchmal denken die Leute, dass diese Impfstoffe über einen Zeitraum von 4 Monaten aus dem Nichts aufgetaucht sind“, sagte Hotez. „Dies ist jedoch kein 4-monatiger Prozess. Dies ist ein 17-jähriger Prozess.“
Die Forschung zu pandemieverursachenden Coronaviren und Impfstoffen zum Schutz vor ihnen begann nach dem Auftreten eines verwandten Virus, das 2003 den SARS-Ausbruch verursachte.
Später arbeiteten Wissenschaftler an Impfstoffen zum Schutz vor dem Coronavirus, das das Atemwegssyndrom im Nahen Osten MERS verursacht, das erstmals 2012 beobachtet wurde.
Während der Sitzung des Beirats am Donnerstag haben die Panelmitglieder nachgedacht
Die Daten zeigten, dass der Impfstoff 7 Tage nach der zweiten Dosis eine Wirksamkeit von 95 Prozent hatte.
Die Wirksamkeit ist ein Maß dafür, wie gut ein Impfstoff in einer klinischen Studie funktioniert. Die Wirksamkeit in der Praxis kann geringer sein.
Eine ähnliche Wirksamkeit wurde bei älteren und jüngeren Erwachsenen sowie bei einer Vielzahl demografischer Gruppen und bei Menschen mit anderen Erkrankungen wie Fettleibigkeit, Diabetes und Herzerkrankungen festgestellt.
Die Vorabanalyse der FDA ergab, dass „keine spezifischen Sicherheitsbedenken festgestellt wurden, die die Erteilung einer EUA oder eine Genehmigung für den Notfall ausschließen würden.“
Die häufigsten Nebenwirkungen bei den Studienteilnehmern waren Schmerzen an der Injektionsstelle, Müdigkeit, Kopfschmerzen, Muskelschmerzen, Schüttelfrost, Gelenkschmerzen und Fieber.
Eine schwerwiegendere Nebenwirkung, die bei einigen Teilnehmern auftrat, waren geschwollene Lymphknoten, die laut FDA wahrscheinlich das Ergebnis des Impfstoffs sind.
Vier Personen, die den Impfstoff erhalten haben, entwickelten sich Bellsche Lähmung ein Zustand, der zu Schwäche oder Lähmung der Muskeln im Gesicht führt. FDA-Wissenschaftler sagten, die Rate sei nicht höher als in der Allgemeinbevölkerung.
Die FDA empfahl jedoch, Personen, die den Impfstoff erhalten, fortlaufend auf diesen Zustand zu überwachen.
Diese Art der Überwachung erfolgt routinemäßig, nachdem ein Impfstoff einen Notfall oder eine vollständige Zulassung erhalten hat. Eine Reihe von Regierungssystemen ist bereits vorhanden, um Nebenwirkungen bei Impfstoffempfängern zu verfolgen.
Im Vereinigten Königreich zwei Beschäftigte im Gesundheitswesen entwickelte Symptome schwerer allergischer Reaktionen nach Erhalt des Impfstoffs. Beide hatten in der Vergangenheit schwerwiegende allergische Reaktionen und trugen jeweils einen Adrenalin-Autoinjektor.
Sie erholen sich gut, berichtete die britische Regulierungsbehörde.
Die Agentur hat vorsorglich auch darauf hingewiesen, dass Personen mit „einer signifikanten Vorgeschichte allergischer Reaktionen“ den Pfizer / BioNTech-Impfstoff erst erhalten, wenn weitere Studien durchgeführt wurden.
britische Aufsichtsbehörden genehmigt der Pfizer-BioNTech-Impfstoff für den Notfall letzte Woche, wobei die ersten Impfungen am Dienstag stattfanden. Kanadas Aufsichtsbehörde folgte mit einem eigenen Notfallgenehmigung Anfang dieser Woche.
Die FDA-Notfallzulassung des Impfstoffs bedeutet nicht das Ende der klinischen Studien. Pfizer wird die Teilnehmer bis zu 2 Jahre lang begleiten, sowohl hinsichtlich Anzeichen anderer Sicherheitsprobleme als auch um festzustellen, ob der durch den Impfstoff gebotene Schutz von Dauer ist.
Es bleiben noch einige Fragen zum Impfstoff offen, einschließlich der Frage, ob der Impfstoff vor asymptomatischen Infektionen schützt, ob er verhindern kann, dass Menschen das Virus auf andere übertragen, und wie lange der Schutz anhält.
Darüber hinaus sind weitere klinische Studien oder weitere Daten erforderlich, bevor die FDA den Impfstoff für Personen unter 16 Jahren, schwangere Frauen und Personen mit geschwächtem Immunsystem empfehlen kann.
Pfizer sagte, es plane, im April 2021 die vollständige Zulassung seines Impfstoffs bei der FDA zu beantragen. Bis dahin werden 6 Monate Sicherheitsdaten gesammelt.
Wenn die FDA die vollständige Zulassung erteilt, kann Pfizer seinen Impfstoff an Krankenhäuser, Apotheken und andere Gesundheitsdienstleister verkaufen.