Ursprünglich veröffentlicht am 29. September 2016.
Wow, was für ein großer Moment für die Diabetes-Community! Am Mittwoch genehmigte die FDA das Minimed 670G von Medtronic, das erste „Hybrid-Closed-Loop-System“, das Glukose automatisch überwachen und die basalen Insulindosen bei Menschen ab 14 Jahren anpassen kannälter mit Typ-1-Diabetes.
Dies ist mit einem Feuersturm der Aufregung verbunden, da es natürlich dem von der FDA zugelassenen am nächsten kommt “
Während wir in der Diabetes-Community feststellen, dass es sich nicht um einen AP mit vollständig geschlossenem Regelkreis handelt, der die Diabetes-Kontrolle vollständig übernimmt, und Medtronic selbst darauf achtet, ihn als „Hybrid“ zu bezeichnen, ist der neue Minimed 670G ein RIESIGER Fortschrittbei der Automatisierung unseres Krankheitsmanagements. Woot!
Hier ist die offizieller Brief von der FDA an Medtronic über diese Freigabe sowie die
Bemerkenswerterweise erfolgt diese behördliche Genehmigung nur 104 Tage !, Nachdem Medtronic Tausende von Seiten mit Dokumenten eingereicht hat, was sieben Monate früher als erwartet ist. Diese Genehmigung umfasst mehr als ein Jahrzehnt Forschung, Richtlinien und Produktentwicklung, um dies zu erreichenMeilenstein.
„Das ist phänomenal und ich bin so aufgeregt!“, Sagt Aaron Kowalski, Chief Mission Officer des JDRF und langjähriger Typ 1 selbst. „Es ist erstaunlich, auf diesem Niveau zu sein. Denken Sie darüber nach - dies ist das erste Malvon diesen automatisierten Systemen wurde genehmigt… und die kurze Zeit, die die FDA brauchte, um dies zu klären. “
Also, was ist dieses neue Glukose-Kontrollsystem und wie funktioniert es?
Der Begriff „Hybrid“ bedeutet in diesem Fall, dass das System teilweise automatisiert ist, jedoch noch eine gewisse Kontrolle durch den Benutzer erfordert.
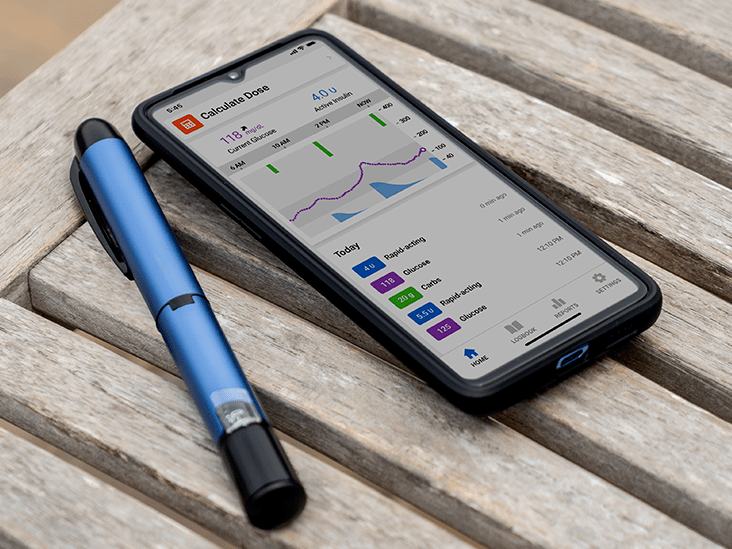
Der CGM-Sensor liest alle fünf Minuten Glukosedaten und der in die Pumpe integrierte Algorithmus mit geschlossenem Regelkreis verwendet diese Informationen, um das Basalinsulin zu erhöhen oder zu verringern und den Glukosespiegel so nahe wie möglich am Ziel von 120 mg zu halten/ dL. Benutzer müssen weiterhin die Anzahl der Kohlenhydrate und die Bolusmengen für die Mahlzeiten eingeben und das System vor jeder Übung benachrichtigen. Es werden auch keine automatischen Korrekturbolusse basierend auf CGM ausgegeben, es werden jedoch Korrekturbeträge vorgeschlagen, wenn ein Fingerstick-Ergebnis eingegeben wirdGenau wie alle Standard-Insulinpumpen jetzt über die Funktion des Bolus-Assistenten.
Manueller Modus - bei dem das System vom Benutzer so programmiert werden kann, dass es Basalinsulin mit einer vorprogrammierten konstanten Rate abgibt. Das System setzt die Insulinabgabe automatisch aus, wenn der Sensorglukosewert unter einen vorgegebenen Schwellenwert fällt oder diesen voraussichtlich unterschreitet.Das System nimmt auch die Insulinabgabe automatisch wieder auf, sobald die Glukosewerte des Sensors über einen vorgegebenen Schwellenwert steigen oder voraussichtlich über diesen hinausgehen.
Auto-Modus - Das System kann die basale Insulinabgabe automatisch anpassen, indem es die Insulinabgabe basierend auf den CGM-Werten kontinuierlich erhöht, verringert oder unterbricht anders als im manuellen Modus, in dem die basale Insulinabgabe mit einer konstanten Rate abgegeben wird. Der automatische Modus kann jedoch die basale Insulinabgabe automatisch anpassenohne Eingabe des Benutzers, Der Benutzer muss während der Mahlzeiten immer noch manuell Insulin abgeben.
Dies ist ein neuer Gerätetyp, der noch nie auf dem Markt gesehen wurde - und die Tatsache, dass er hier in den USA zuerst zugelassen wurde, bevor er auf den europäischen und internationalen Markt gelangt, kann kaum übertrieben werden.
Äußerlich sieht der Minimed 670G fast identisch aus und fühlt sich auch so an wie der des Unternehmens. kürzlich genehmigter Minimed 630G Dies bringt eine neue vertikale Ausrichtung und Farbbildschirmanzeige in das Standardpumpendesign von Medtronic.
Der große Unterschied besteht darin, dass diese Insulinpumpen-CGM-Kombination von einem ausgeklügelten Algorithmus gesteuert wird, den Medtronic als „SmartGuard Hybrid Closed Loop-Technologie“ bezeichnet, mit der bei Bedarf automatische Anpassungen des Basalinsulins und der automatischen Abschaltung vorgenommen werden könnensind wie folgt:
- Pumpeneinheit : Wie bereits erwähnt, sieht es genauso aus wie Minimierter 630G erst letzten Monat eingeführt bereits veraltet?. Gleiche AA-Batterie, gleiche Infusionssets und Insulinreservoir mit 300 Einheiten und etwas größer als die traditionell gestalteten Minimed-Pumpen mit horizontaler Ausrichtung. Im Gegensatz zu älteren Medtronic-PumpenDieses Gerät wird nur in Schwarz angeboten, aber Sie können eine Reihe verschiedener Skins kaufen, um den Look auf Wunsch aufzupeppen.
- Schaltflächen und Menüs : Die einzigen geringfügigen Unterschiede zwischen dem 630G und dem neuen MiniMed 670G sind die Tatsache, dass Sie mit der Schaltfläche oben rechts direkt zu CGM-Diagrammen gelangen und nicht zum Pfad zu den Menüs. Das Menü selbst unterscheidet sich aufgrund der neuen Modusoptionen usw.., auf dem neuen System.
- Farbbildschirm : Wie das 630G verfügt auch das neue System über einen hellen Vollfarbbildschirm !, Der sich automatisch an Beleuchtungssituationen anpasst, sodass er beispielsweise nachts nicht so hell aufleuchtet wie tagsüber. Dies scheint zu seinEs ist viel einfacher zu lesen, ein großer Vorteil für alle mit Sehbehinderungen. Neben den grundlegenden Pumpen- und CGM-Daten wird Insulin on Board IOB direkt auf dem Homescreen angezeigt - etwas, wonach Benutzer verlangt haben.
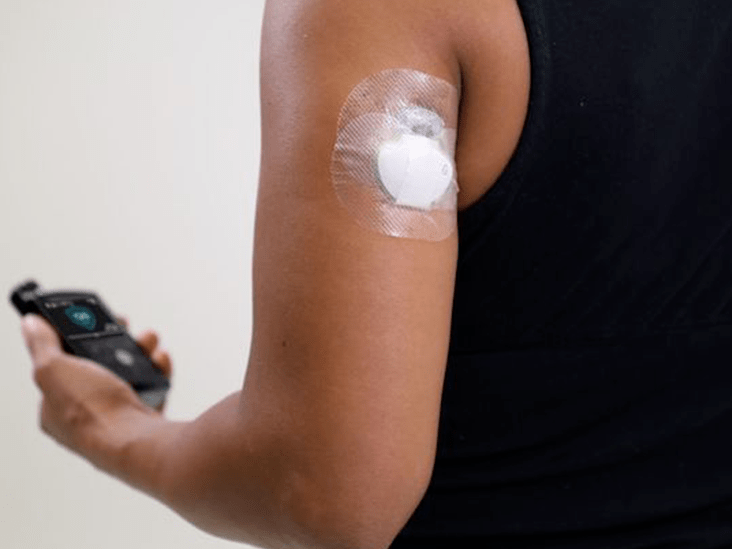
- CGM Tech : Das neue System verwendet den muschelförmigen CGM-Sensor der vierten Generation von Medtronic, der als Enlite 3 bezeichnet wurde, jetzt aber als Guardian 3-Sensor bezeichnet wird wir haben einen Überblick über alle verschiedene Medtronic-Begriffe über Storify .Die FDA hat die Genehmigung erteilt, 7 Tage am Körper zu tragen, verglichen mit 6 Tagen bei früheren Generationen.An der Klebevorderseite ist jedoch nichts Neues.
- Verbesserte Genauigkeit : Der Guardian 3 ist zuverlässiger und genauer, sagt Medtronic, da er ein neues Funksignal eingeführt mit dem 630G verwendet, um zwischen Sender und Sensor zu kommunizieren. Laut Angaben des Unternehmens klinische Zulassungsdaten Bei zwei Kalibrierungen pro Tag liegt die MARD-Fehlerrate im Durchschnitt bei 10,55%, was mit 9% nicht so gut ist wie beim neuesten Dexcom G5, aber viel besser als die ~ 14%, die das aktuelle Enlite zu bieten hatein potenzieller Wegbereiter, um Medtronic zu einem stärkeren Konkurrenten auf dem CGM-Markt zu machen!
- Ihr Modus kann variieren : Medtronic sagt, es hat den Leuten zugehört, die eine Auswahl wünschen, und ermöglicht daher das Umschalten zwischen den Modi: Auto-Modus für die Hybrid-Closed-Loop-Funktion oder Manueller Modus, der weiterhin die Funktion Suspend on Low bietet, wenn Sie diesen Hypo-Schwellenwert überschreiten wie z530G und 630G haben beide und das Suspend Before Low, das eingestellt werden kann, um Hypos 30 Minuten vor ihrem Auftreten vorherzusagen wie beim international erhältlichen 640G.
- Hintergrundziel festlegen : Diese Technologie wurde entwickelt, um das Ziel zu erreichen. Dies bedeutet, dass der Blutzuckerspiegel so nahe wie möglich an 120 mg / dl gehalten wird. Leider kann dies nicht geändert werden. Dies bedeutet, dass Medtronic bisher nur die „Personalisierung und Anpassung“ vornimmtDer Benutzer kann ein temporäres Ziel von 150 mg / dl für bis zu 12 Stunden festlegen, um Situationen wie Bewegung zu bewältigen. Dies ist jedoch die einzige eingebaute Flexibilität. Medtronic sagt, dies sei das Ergebnis des Versuchs, zuerst auf den Markt zu kommen, da unterschiedliche Ziele zulässig sindDies würde viel größere klinische Studien bedeuten, die die behördliche Zulassung und Vermarktung verzögert hätten. Zukünftige Generationen werden wahrscheinlich unterschiedliche Zielwerte zulassen, sagt Medtronic.
- Kein Datenaustausch : Wie das frühere Minimed 630G-System verfügt auch dieser 670G Hybrid Closed Loop nicht über integriertes Bluetooth und funktioniert nicht mit Minimed Connect für die gemeinsame Nutzung von Mobiltelefondaten ?!. Für diejenigen, die Daten gemeinsam nutzen möchten, weist Medtronic die Benutzer auf ihr Minimed 530G-System hin, das inzwischen mehr als drei Jahre alt ist. Aufgrund dieser mangelnden Konnektivität hat das 670G gewonnenarbeite nicht mit einem der IBM Watson oder mobile Apps für den Datenaustausch in Entwicklung
- Angeschlossenes Blutzuckermessgerät : Das System ist so eingerichtet, dass es direkt mit dem Bayer Contour Link 2.4 Meter kommuniziert. Ascensia eingeführt mit der Startansage des 630G. Dies ermöglicht das Remote-Bolusing vom Messgerät aus, jedoch nur im manuellen Modus und nicht im automatischen Modus mit geschlossenem Regelkreis.
- Täglich zwei Kalibrierungen : Das System erfordert alle 12 Stunden mindestens eine Fingerstick-Kalibrierung. Wenn es nicht eingegeben wird, wird der Benutzer automatisch aus dem Auto-Modus ausgeschaltet.
- One-Press-Serter : Der 670G verwendet den neuen Medtronic One-Press-Serter das heißt, es macht das Einsetzen des Sensors einfacher und komfortabler. Es erfordert nur einen einzigen Tastendruck im Vergleich zum Serter der vorherigen Generation, der sperriger war und zwei Tastendrücke erforderte einmal zum Einsetzen und einmal zum Zurückziehen.
- Kinder und Jugendliche : Minimed 670G ist offiziell für Kinder ab 14 Jahren gekennzeichnet, das Unternehmen gibt jedoch an, dass bereits Zulassungsstudien für Kinder zwischen 7 und 13 Jahren sowie Machbarkeitsstudien für Kinder ab 2 Jahren durchgeführt werden. In dem aktuellen FDA-Zulassungsschreiben wird dies ausdrücklich angegebendas 670G sollte nicht kann bei Personen unter 7 Jahren oder bei Personen verwendet werden, die weniger als 8 Einheiten Insulin pro Tag einnehmen da das Gerät ein Minimum pro Tag benötigt, um sicher zu arbeiten .Metronic gibt an, dass in diesen nicht genügend Daten vorhanden sinddie weniger als 8 Einheiten pro Tag benötigen, um zu wissen, ob der Algorithmus effektiv und sicher ist.
Mit der viel schneller als erwarteten behördlichen Genehmigung sagt Medtronic, dass sie mindestens sechs Monate benötigen, um sich auf die Produkteinführung in den USA ab Frühjahr 2017 vorzubereiten. Für diejenigen außerhalb der USA erwartet Medtronic, dass die behördliche Genehmigung irgendwann in der Mitte erwartet wird-2017.
Es gibt viele „bewegliche Teile“, die vor dem Start hier in Amerika installiert werden müssen, erklären sie, und sie befinden sich derzeit mitten in der Einführung des Minimed 630G, zu dem das Vorgängermodell erst kürzlich ausgeliefert wurdePatienten in den USA
Ja, es wird einen Upgrade-Pfad für alle geben, die aktuelle Medtronic-Produkte verwenden - die so genannten Priority Access-Programm . Es ermutigt Kunden tatsächlich, in den kommenden Monaten vor dem Markteintritt des 670G mit dem Minimed 630G zu beginnen, und wirbt dafür, dass ein solcher Übergang den Patienten hilft, auf die neue Plattform zu trainieren und möglicherweise ihre Auslagenkosten auf ein niedriges Niveau zu senkenals $ 0.
- Anfangskosten des Priority Access-Programms = 799 USD
- Inzahlungnahmeguthaben für MiniMed 630G-Pumpe und CGM-System = 500 USD
- Gesamtkosten des Programms aus eigener Tasche = nur 299 USD
- Die Teilnahme an Umfragen und anderen Benutzer-Feedback-Programmen kann diese Kosten auch auf 0 US-Dollar senken, so das Unternehmen.
Das Priority Access-Programm läuft bis zum 28. April 2017. Medtronic sagt außerdem, dass weitere Angebote und Upgrade-Möglichkeiten möglicherweise näher an der Startzeit im Frühjahr bekannt gegeben werden.
Natürlich wird Medtronic in den kommenden Monaten auch mit Zahlern und Versicherungsunternehmen an der Deckung dieser Technologie arbeiten. Bei all den jüngsten Kontroversen über diese Themen #DiabetesAccessMatters , wir hoffen, Medtronic denkt daran, dass viele Patienten dieses System zwar wollen, es aber möglicherweise nicht für alle die beste Wahl ist - und die Wahl ist wichtig!
Der JDRF hat a Pressemitteilung am Mittwoch drückte er seine Begeisterung über diese wegweisende Technologie aus und wie schnell sich die FDA bewegte. Die American Diabetes Association mischte sich ebenfalls mit ein Pressemitteilung bei dieser Genehmigung unter Hinweis auf ihre Bedeutung.
Denken Sie darüber nach: Vor zehn Jahren dachten viele noch, ein System mit geschlossenem Regelkreis sei ein Wunschtraum. Aber JDRF hat es ausgelegt. eine echte Blaupause auf dem Weg zu einer künstlichen Bauchspeicheldrüse. Das waren noch die Anfänge der CGM-Technologie… und schauen Sie, wie weit wir gekommen sind!
„Dies ging unglaublich schnell voran und zeigt, wie wichtig all die harte Arbeit war, die wir damals auf politischer Seite geleistet haben, um Leitlinien für diese Systeme zu erstellen“, sagte Kowalski, der persönlich eine wichtige Rolle bei der Erstellung von AP spielteTechnische Entwicklung hat Priorität. „Das hat alles verändert und einen Weg geschaffen, und jetzt sind wir hier. Es ist massiv, wirklich ein Wendepunkt, der das Potenzial hat, die Diabetesversorgung zu verändern!“
Ob Sie das Minimed 670G als „künstliche Bauchspeicheldrüse“ betrachten oder nicht, ist fast nebensächlich… Tatsache ist, dass wir jetzt ein Gerät haben, das die Schleife auf eine Weise schließt, die wir zuvor noch nicht gesehen haben und die eine frühe AP-Generation darstelltlebensverändernde Technologie, die in Rekordzeit zur Verfügung gestellt wurde.
Tatsächlich erteilte die FDA die Marktzulassung für diesen Minimed 670G und erforderte zusätzliche Studien nach dem Inverkehrbringen, um besser zu verstehen, wie das Gerät in realen Umgebungen funktioniert. Dies zeigt, dass die FDA bereit ist, vorhandene Daten zu prüfen und dem zu vertrauenVorteile, ohne sich für Unmengen zukünftiger Daten zurückzuhalten.
Die Reise ist in der Tat ziemlich erstaunlich, wie in diesem Beitrag von D-Mom und der langjährigen JDRF-Anwältin Moira McCarthy Stanford festgehalten wie die Organisation den Weg ebnete bis zu diesem Meilenstein und darüber hinaus.
Wir haben auch mit gesprochen Jeffrey Brewer Leiter von Bigfoot Biomedical, das ein eigenes System mit geschlossenem Regelkreis entwickelt, das voraussichtlich 2018 verfügbar sein wird. Zusammen mit Aaron Kowalski gilt Brewer aufgrund seiner Rolle bei der Entwicklung als einer der „Väter des AP“und den Closed-Loop-Pfad am JDRF fördern.
"Wir freuen uns, dass sich die FDA schneller bewegt und automatisierte Insulinabgabesysteme besser unterstützt, und wir scheinen von denselben Winden unterstützt zu werden!", Sagte Brewer.
Zweifellos wird dies die Nadel bei den mehr als 18 anderen Systemen mit geschlossenem Regelkreis vorwärts bewegen - insbesondere bei solchen, die nur Insulin verwenden. Einige fügen der Mischung das zusätzliche Hormon Glucagon hinzu, um Hypoglykämie zu bekämpfen wie Beta Bionics iLET und PancreumGenesis, für die möglicherweise mehr FDA-Evaluierungszeit erforderlich ist.
Wir freuen uns, unsere Freunde in der Do-it-yourself-Community unter zu hören. #OpenAPS sind auch aufgeregt über diese neueste Genehmigung und was sie für uns alle bedeutet.
Es ist großartig zu sehen, dass sich die FDA nicht nur bei dieser Minimed 670G-Zulassung, sondern auch bei anderen aufregenden Entwicklungen im Bereich Diabetes-Technologie und Daten in den letzten Jahren so schnell bewegt. Die FDA erkennt dies eindeutig an. #WeAreNotWaiting Bewegung und tun ihr Bestes, um mit diesen sich schnell bewegenden Zeiten Schritt zu halten.
Es ist erwähnenswert, dass die FDA am Mittwoch auch grünes Licht für die Abbott Freestyle Libre Pro System hier in den USA
Dies ist kein Verbrauchergerät, sondern die klinische Version von Abbotts neues Flash Glucose Monitoring FGM Technologie, die Patienten im Ausland bereits zur Verfügung steht.
Auch als „Hybrid“ -System bezeichnet - jedoch nur zur Glukoseüberwachung - Abbott Libre besteht aus einem kleinen runden Sensor, der bis zu 14 Tage lang auf der Rückseite des Oberarms getragen wird, und einem Controller, als den Benutzer einfach darüber streichenviele Male pro Tag nach Bedarf oder Wunsch, um drahtlose Glukosemessungen durchzuführen.
Es bietet keine Alarme für steigende oder fallende Glukosespiegel, und die Consumer-Version im Ausland speichert nur 8 Stunden Daten. Ziel ist es, eine einfachere Überwachungslösung zu erstellen, die auch dazu beitragen kann, dass viele Typ-2-Patienten besser mit ihren in Kontakt stehenGlukosespiegel in Echtzeit.
Obwohl Abbott kein traditionelles CGM ist, wie wir es kennen, klassifizieren die gesetzlichen Vorschriften Libre als CGM. Und was sie jetzt genehmigt haben, ist eine Version, die speziell für Ärzte entwickelt wurde, um sie ihren Patienten für den kurzfristigen Gebrauch zu leihen, und das auchEs werden nur verblindete Daten angezeigt, die von den Ärzten angezeigt werden können. Dies ist ein erster Schritt in Richtung der Consumer-Version. Abbott hat kürzlich auch die FDA-Zulassung beantragt hier in den Staaten.
Hoffentlich wird das bald kommen, mit der scheinbar eskalierten Innovationsspur der FDA.
Ein großes Dankeschön an alle Beteiligten - nicht zuletzt an die FDA - für die Weiterentwicklung dieser wichtigen Tools zur Diabetesversorgung in unserem besten Interesse!