Die Ankunft eines neuen Jahres bringt immer mehr Hoffnung auf neue Fortschritte bei Diabetes-Tools und -Pflege. In diesem Jahr sind die technischen Erwartungen besonders hoch, da wir kurz vor einem Boom bei Systemen mit geschlossenem Regelkreis stehen, die sich teilweise automatisierenInsulinabgabe aka Künstliche Bauchspeicheldrüsen-Technologie .
Unser Team in der Mine hat den Gewinnaufrufen der Branche zugehört, mit Insidern von Unternehmen gesprochen und im Allgemeinen „die Teeblätter gelesen“, was sich am Horizont abzeichnet. Hier ist eine Zusammenfassung dessen, was wir für 2020 in der Diabetes-Technologie erwarten, mit einigen unserer eigenen Erkenntnisse und Beobachtungen :
Tandem-Diabetes-Pflege
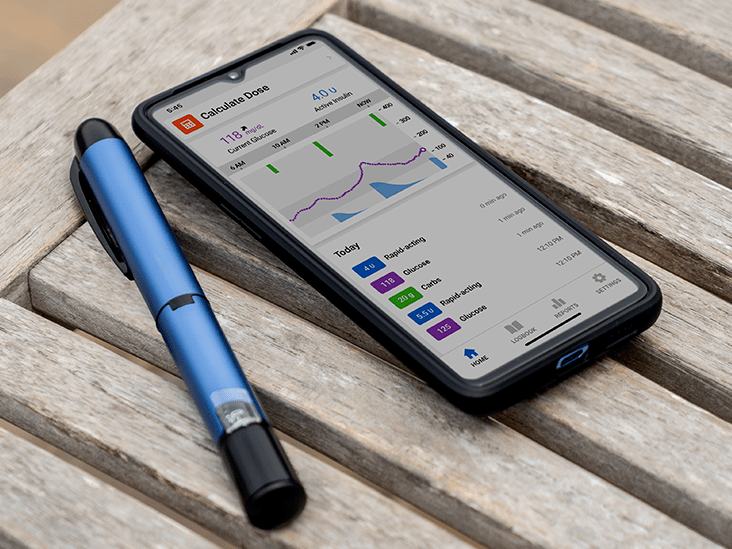
Control-IQ : Die FDA-Zulassung dieser neuen Technologie von Tandem war die große Jahresendgeschichte für 2019. Control-IQ wird zum fortschrittlichsten kommerziellen Closed-Loop-System auf dem Markt. Tandem wird es ab Mitte Januar 2020 zusammen mit einer neuen mobilen App einführen, die das automatische Hochladen von Diabetes-Gerätedaten auf die t: connect-Webplattform ermöglichtEs wird mitgeteilt, dass ab Mitte 2020 schrittweise neue Funktionen für diese mobile App vorgestellt werden, einschließlich der Datenanzeige und der Integration anderer Gesundheitsdaten. Schließlich werden sie die vollständige Steuerung der t: slim X2-Insulinpumpe über die App per Mobiltelefon ermöglichen! Siehe unsere vollständige Abdeckung von Control-IQ hier .
t: Sport-Minipumpe : 2020 wird möglicherweise auch eine neue Tandem-Minipumpe mit dem Namen „ t: Sport. ”Es wird eine Art Hybrid sein, ungefähr halb so groß wie die t: slim X2-Pumpe und überhaupt ohne Bildschirm. Insbesondere wäre es die erste Option im Patch-Pump-Stil nach Omnipod und enthält eine Seitentaste fürEine schnelle Insulindosis vom Gerät selbst. Der t: sport hat einen am Körper haftenden Klebeteil auf der Rückseite, löst sich jedoch ab und auch den typischen Pigtail-Insulinschlauch des t: slim, der am Infusionsset für Insulin befestigt wirdLieferung. Nachdem Control-IQ genehmigt und eingeführt wurde, treibt Tandem die Einreichung des t: sport für die FDA-Überprüfung Mitte 2020 voran. Die Hoffnung besteht darin, den Kunden die Wahl zu geben, wie sie ihn verwenden möchten: entweder über ein SmartphoneApp oder ein separates Empfängergerät. Die erste FDA-Einreichung zur Jahresmitte konzentriert sich auf den Handheld-Empfänger, während sich eine spätere Einreichung im Jahr 2020 auf die Steuerung der mobilen App des Geräts konzentriert. All dies hängt von der Entscheidung der FDA ab, aber wirIch bin optimistisch angesichts des Erfolgs von Tandem, Control-IQ aus der Tür zu bekommen.
Omnipod von Insulet
Omnipod Horizon Closed Loop : In der Hoffnung auf eine kommerzielle Version eines Closed-Loop-Systems mit einer Patch-Pumpe? Dies könnte das Jahr sein, in dem Insulet Corp. sein offizielles Closed-Loop-System mit dem Namen einführt. Omnipod Horizon .
Im Jahr 2019 brachte das Unternehmen für Insulin-Patch-Pumpen seine Vorgängerversion Omnipod DASH auf den Markt, und wir haben auch eine Do-It-Yourself-Version von Loop herausgebracht. kompatibel mit der Omnipod-Schlauchpumpe . Wir freuen uns, dass eine „offizielle“ Version dieses Systems mit potenzieller Steuerung der mobilen Smartphone-App hoffentlich bald in diesem Jahr verfügbar sein wird. Insulet geht davon aus, dass die Einreichung zur Jahresmitte mit einer hoffnungsvollen Genehmigung und einem begrenzten Start bis Ende 2020 erwartet wirdund eine vollständige kommerzielle Einführung im Jahr 2021.
Medtronic Diabetes Closed Loop
Advanced Hybrid Closed Loop AHCL oder 780G : Bekannt gegeben im Rahmen der ADA Scientific Sessions im Juni 2019 Dieses „Advanced Hybrid Closed Loop ACHL -System“ der nächsten Generation wird den Grundformfaktor der 6er-Modelle des Unternehmens mit einem vertikalen „modernen“ Aussehen haben, verglichen mit den älteren Modellen mit einem horizontalen Design, das den 1980er Jahren ähneltPager.
Der 780G verwendet einen neuen Algorithmus, der laut Angaben des Unternehmens genauer und zuverlässiger ist. Er bietet eine automatische Korrekturbolusierung, passt sich automatisch an versäumte Mahlzeiten an und ermöglicht ein einstellbares Glukoseziel von bis zu 100 mg / dl im Vergleich zum 670G-SatzZiel bei 120 mg / dl. Ziel ist es auch, eine Benutzerzeit in Reichweite von 80% im Vergleich zu den vorhandenen 71% TIR zu erreichen, die in den Daten zum 670G angegeben sind.
Wichtig ist, dass diese BLE-fähige Pump-CGM-Kombination die Aktualisierung der Remote-Software ermöglicht - wie von Tandems t: slim X2 angeboten -, sodass Benutzer nicht bei jedem Start neuer Funktionen ein ganz neues Gerät kaufen müssenMedtronic gibt an, die mit BLE verbundene Komponente dieses Geräts bereits bei der FDA eingereicht zu haben. Derzeit laufen klinische Studien siehe. hier und hier und sollte bis Mitte 2020 abgeschlossen sein.Das ursprüngliche Ziel des Unternehmens für April 2020 erscheint zu ehrgeizig, da der 780G-Zulassungsversuch voraussichtlich erst Mitte des Jahres abgeschlossen sein wird.Wenn Medtronic dieses Gerät jedoch archiviert, könnte es Ende 2020 auf den Markt kommen.
Hinweis auch : Zuvor hatte Medtronic angekündigt, eine BLE-fähige Version des 670G auf den Markt zu bringen, die Remote-Sharing und Datenanzeige über eine mobile App ermöglicht. MedT hat jedoch jetzt mitgeteilt, dass die angeschlossene 670G-Version nicht mehr geplant istund wird sich stattdessen darauf konzentrieren, den 780G mit integriertem BLE so schnell wie möglich auf den Markt zu bringen.
Abbott Diabetes Care
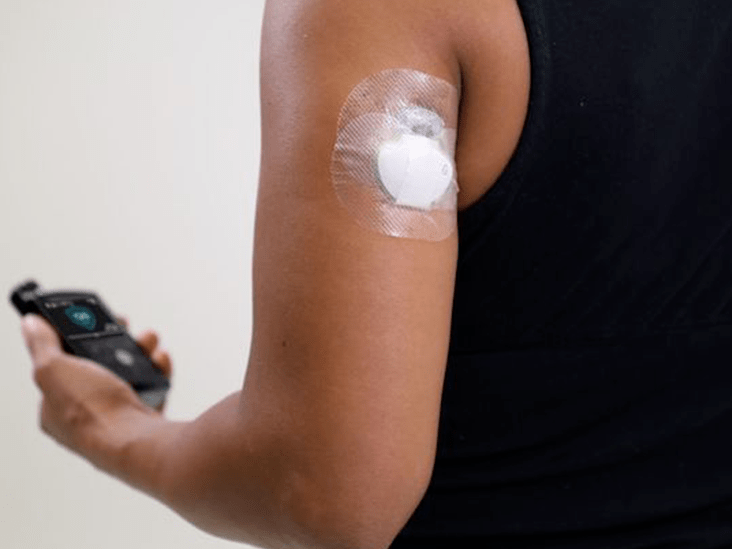
Libre 2.0 : Wir warten immer noch darauf, nachdem das Unternehmen es Anfang letzten Jahres den Aufsichtsbehörden vorgelegt hat. Diese Version der nächsten Generation von FreeStyle Libre Flash-Glukoseüberwachungssystem FGM Enthält einen kleinen runden Sensor in Plattengröße am Arm, den Sie mit einem Empfängergerät scannen, um Glukosewerte zu erhalten. Der Libre 2.0 sendet über Bluetooth Low Energy BLE optionale Warnungen, die Sie alarmieren, wenn Sie sich außerhalb der Reichweite befinden.um Sie zu einer Fingerstick-Überprüfung aufzufordern, um einen tatsächlichen niedrigen oder hohen Messwert zu bestätigen.
Wir haben gehört, dass die FDA überlegt hat, ob sie diesem Gerät das gewähren soll
Dexcom CGM
Dexcom strebt einen ersten Start seiner nächsten Generation Ende 2020 an. Modell G7 seit mehreren Jahren in Arbeit als Zusammenarbeit mit Verily früher Google Life Sciences. Während Details noch spärlich sind, hat Dexcom einige große Überarbeitungen des G7 angedeutet :
verlängerte Abnutzung von 14-15 Tagen : Dies führt zu vier bis fünf zusätzlichen Tagen im Vergleich zum aktuellen 10-Tage-Verschleiß des Dexcom G6. Wie beim G6 sind keine Fingerstick-Kalibrierungen erforderlich.
Vollwegartikel : Im Gegensatz zu den bisherigen Dexcom CGM-Modellen ist der G7 vollständig wegwerfbar, sodass Sie keinen separaten Sender mit einer Batterielebensdauer von drei Monaten haben. Stattdessen werden Sensor und Sender vollständig integriert und sobald der Sensor läuftWenn Sie fertig sind, entsorgen Sie die gesamte integrierte Einheit.
dünner : Dexcom sagt, dass der G7 die dünnste Generation seiner CGM-Sensoren sein wird, aber das Unternehmen hat keine spezifischen Details zu Messungen oder Design veröffentlicht.
Entscheidungsunterstützung : Obwohl wir noch nicht gesehen haben, dass dies in die vorhandene G6-Technologie integriert ist, ist dies immer noch möglich und wird wahrscheinlich in die zukünftige G7 integriert. Dexcom hat bereits darüber gesprochen, um die CGM-Verwendung für weitere Typ-2-Geräte und darüber hinaus zu erweiternMenschen mit Diabetes. Angesichts der Übernahme von TypeZero durch Dexcom und der Tatsache, dass dies jetzt intern erfolgt, werden wir wahrscheinlich weitere Softwarefunktionen wie Dosierungsunterstützung und Interaktion in die Dexcom CGM-Angebote aufnehmen, wenn wir fortfahren.
Dexcom hat die G7 noch nicht bei der FDA eingereicht, aber nach dem Ergebnisaufruf für das dritte Quartal im November 2019 planen sie eine begrenzte Markteinführung Ende 2020, gefolgt von einer breiteren kommerziellen Markteinführung im Jahr 2021. Das kalifornische Unternehmenhat seine Produktionskapazität im vergangenen Jahr mit G6 erhöht und sagt, dass dies den Weg für eine reibungslose Einführung seines Produkts der nächsten Generation ebnet.
Natürlich arbeitet das Unternehmen auch daran, die Probleme mit Serverausfällen zu beheben, die 2019 zweimal aufgetreten sind - einmal während der Neujahrsferien 2018-2019 und länger über das Thanksgiving-Wochenende 2019. CEO Kevin Sayer entschuldigte sich bei YouTube für das Ende des Jahres, insbesondere mit der Feststellung, dass Ingenieure einen Plan zur Implementierung von In-App-Benachrichtigungen für den Fall eines zukünftigen Ausfalls des Datenaustauschs beschleunigen. Dexcom plant dies ebenfalls. Unternehmenswebsite aktualisieren mit einer Zielseite, auf der Aktualisierungen der Systemfunktionalität rund um die Uhr angezeigt werden.
Eversense Implantable CGM
Mobile App : Ab Ende 2019 verfügt dieses implantierbare 90-Tage-CGM von Senseonics über eine „Dosierungsanspruch“ der FDA - was bedeutet, dass zusammen mit Abbott Libre und Dexcom keine Fingerstick-Kalibrierungen erforderlich sind, um die Messwerte zu bestätigen, bevor Insulin dosiert oder andere Behandlungsentscheidungen getroffen werden. Seltsamerweise das Unternehmen neue mobile App erfordert immer noch zwei Kalibrierungen pro Tag, um eine kontinuierliche Genauigkeit über die 90-tägige Sensorlebensdauer sicherzustellen. „Die neue App ermöglicht jedoch auch Flexibilität bei Ihren Kalibrierungszeiten“, sagt Senseonics.
Längerer Verschleiß : Wir warten auf die Verfügbarkeit eines 180-Tage-Sensors mit längerer Lebensdauer in den USA außerhalb der USA als Eversense XL erhältlich. Dies bedeutet, dass Benutzer ihn nur alle sechs Monate implantieren und ersetzen müssen, im Vergleich zu allen drei MonatenSenseonics geht davon aus, dass die behördliche Genehmigung bald mit einem voraussichtlichen Start im Jahr 2020 erwartet wird.
Bluetooth-Konnektivität für Afrezza
Hallo, BluHale! MannKind Corp., Hersteller von inhaliertem Insulin von Afrezza, teilt uns mit, dass sie 2020 ein BluHale Pro speziell für Gesundheitsdienstleister auf den Markt bringen werden. Dieser Zusatzadapter Ermöglicht dem Afrezza-Inhalationsgerät die Konnektivität.
Während BluHale Pro anfänglich keine Dosierungsdaten enthält, überwacht es die Inhalationstechnik, die Ärzte anwenden können. Schulung neuer Patienten . Das Gerät ist mit Android-, iPhone- und Microsoft-Geräten kompatibel. Es blinkt grün, wenn der Afrezza richtig eingeatmet wird, und rot, wenn nicht. Ärzte können die erfassten Daten zu diesen Fällen anzeigen und ihren Patienten dann Ratschläge geben, wieum Afrezza optimal zu nutzen. BluHale wird schließlich auch in der Lage sein, Dosierungsdaten zu verfolgen und zu teilen.
Michael Castagna, CEO von MannKind, sagt, dass sie auch planen, bald mit ihrer pädiatrischen Phase-3-Studie zu beginnen. Dies ist der letzte Schritt, bevor das regulatorische OK für die Anwendung von Afrezza bei Kindern angestrebt wird.
Xeris Glucagon Pen
Gvoke HypoPen : Im Herbst 2019 bekam Xeris aus Chicago FDA-Zulassung für das weltweit erste gebrauchsfertige stabile flüssige Glucagon Notfallstift, wie ein EpiPen zur Diabetesrettung. Das Unternehmen entschied sich jedoch dafür, zuerst seine vorgefüllte Spritzenoption vor dem Einweg-HypoPen auf den Markt zu bringen, der jetzt im Juli 2020 erwartet wird.
Die mit Spannung erwartete Version mit automatischem Injektor enthält eine 6-mm-Nadel, aber Sie werden die Nadel nie sehen, da der Stift für eine schnelle einmalige Verwendung und Entsorgung in sich geschlossen ist. Im Gegensatz zu vorhandenen Glucagon-Kits ist dies eineEinfacher zweistufiger Vorgang: Ziehen Sie einfach die rote Kappe ab und drücken Sie den Gvoke HypoPen fünf Sekunden lang auf die Haut, bis das Fenster rot wird. Das war's! Dann fährt der Stift automatisch ein und rastet ein, sodass er nicht mehr sein kannDer nicht versicherte Barpreis beträgt 280 USD pro Injektor, genau wie bei der Fertigspritze.
Lilly Connected Pens und mehr
Neuer verbundener Stift : Im Dezember 2019 genehmigte die FDA Lillys vorgefüllten Einweg-Insulinstift, der als Grundlage für ihre neue stiftbasierte vernetzte digitale Plattform dienen soll. Das Unternehmen gibt an, eng mit der FDA zusammenzuarbeiten, um die gesetzlichen Anforderungen für zusätzliche Komponenten der Plattform zu ermitteln.einschließlich des Anhangs, der Insulindosierungsdaten vom Stift an eine mobile App überträgt. Letztendlich funktioniert dies mit dem Dexcom CGM kontinuierlicher Glukosemonitor, as die beiden Unternehmen haben gerade eine Vereinbarung unterzeichnet zu diesem Zweck. Alles wird zusammen gestartet, sobald die FDA die angeschlossene Stiftplattform genehmigt hat.
Lilly sagt uns auch, dass sie auf der bevorstehenden ATTD-Konferenz, die Ende Februar in Madrid stattfindet, Forschungsergebnisse zu „einer potenziellen mobilen App präsentieren werden, die eine personalisierte proaktive Anleitung bietet… rund um das Training“. Dies wird Teil ihres „größeren Connected“ seinPflegeprogramm. ”
ultraschnelles Lispro-Insulin uRLi : Dies ist ein neues, noch schneller wirkendes Insulin für die Mahlzeiten. Aktuelle klinische Daten zeigt, dass uRLi im Vergleich zu Humalog und anderen Insulinen zur Essenszeit, die bis zu 27 Minuten dauerten, um den Glukosespiegel zu beeinflussen, 13 Minuten betrug. Es reduzierte auch die Spitzen nach der Mahlzeit dramatischer. Lilly reichte URLi bei den Aufsichtsbehörden in den USA einsowie Europa und Japan im Jahr 2019, und der Pharmakonzern erwartet für 2020 eine behördliche Genehmigung in allen drei Märkten.
Neue Hybrid Patch Pump : Lillys hybrides System mit geschlossenem Regelkreis befindet sich noch in der Entwicklung, und das Unternehmen plant, bald Daten zur Machbarkeit vorzulegen. Wir gehen zwar nicht davon aus, dass dies im Jahr 2020 eingeführt wird, erwarten jedoch Aktualisierungen zur Entwicklung und zu frühen Versuchen.
WaveForm Cascade CGM : WaveForm Technologies ist a Ausgründung der Gerätefirma AgaMatrix und sie entwickeln ein neues CGM, das 2020 bei der FDA eingereicht wird, aber dieses Jahr voraussichtlich nicht verfügbar sein wird.
Das Gerät, das empfangen hat CE-Kennzeichnung im November 2019 ist ein 14-Tage-CGM-Sensor mit einem wiederaufladbaren quadratischen Sender, der über Bluetooth mit mobilen Android- und iOS-Apps kommuniziert. Bei einem kürzlich abgehaltenen Treffen der Diabetes Technology Society zeigte das Unternehmen ein wissenschaftliches Poster mit konzeptionellen Bildern und Genauigkeitsdaten11,9% MARD, es ist nicht so gut wie bestehende CGMs, aber auf dem Niveau der meisten Iterationen der ersten Generation. Klinische Studien in den USA und der Start in Übersee werden für 2020 erwartet, und WaveForm teilt uns mit, dass sie einen Start im Jahr 2021 hier in den USA planen.
BD Patch Pump für T2 : Wir waren auch mehrere Jahre warten Auf dieser neuen voll wegwerfbaren, dreitägigen, schlauchlosen Pumpe des Pharma-Riesen BD für drei Tage. Sie bietet sowohl Basal- als auch Bolus-Dosierung, fasst 300 Einheiten und verfügt über einen wiederverwendbaren Handheld-Controller mit Bluetooth-Verbindung zu einer Smartphone-App.
BD hat darüber gesprochen, dass das sehr einfache Pumpendesign mit der Insulininjektionstherapie für Menschen mit Typ-2-Diabetes vergleichbarer ist, was es möglicherweise zu einer besseren Option für diejenigen macht, deren Versicherer sich der Genehmigung einer herkömmlichen Insulinpumpe mit vollem Funktionsumfang widersetzen werdenIm August 2019 gab BD bekannt, dass sie ihren FDA-Antrag für dieses Produkt zurückgezogen hat. Der damalige CEO Victor Forlenza der im September 2019 ersetzt wurde betonte jedoch weiterhin, dass BD mit einem F & E-Partner eines Drittanbieters daran arbeite und „weiterhin engagiert sei”Zur Patchpumpe.
Tidepool Loop : Die kostenlose Software und Open-Source-Daten Tidepool baut ein geschlossenes System auf, das sowohl die DIY-Welt als auch die von der FDA regulierte kommerzielle Seite zusammenbringt. Während es auf den hausgemachten DIY-Loop-Systemen basiert, ist dieses separate System Gezeitenpoolschleife Die mobile App funktioniert mit der Dexcom CGM- und Omnipod-Tubeless-Patchpumpe und ist zunächst für iOS verfügbar. Wir haben erfahren, dass die Organisation im ersten Halbjahr 2020 mit Aufsichtsbehörden zusammenarbeitet und klinische Studienforschung betreibtdie FDA bis zum Jahresende. FYI : Tidepool aktualisiert seinen Fortschritt im Blog der Organisation also behalten Sie das auch im Auge.
Bigfoot Biomedical : Diese # WeAreNotWaiting-Technologie mit geschlossenem Regelkreis ist weiterhin aufregend, aber die Pläne sind etwas anders als vor einem Jahr. Das Startup verwendet weiterhin das Basisdesign der ehemaligen Asante Snap-Insulinpumpe für sein Hauptprodukt namens Bigfoot Autonomy.Zuvor hoffen wir jedoch noch auf Fortschritte bei der Version mit verbundenem Stift namens Bigfoot Unity im Jahr 2020. Bei unserer jüngsten Veranstaltung an der DiabetesMine University im November CEO Jeffrey Brewer legte einen Zeitplan für 2021 vor für das Unity-Produkt der ersten Generation mit einer Version der nächsten Generation im folgenden Jahr. In jüngerer Zeit hören wir jedoch, dass Bigfoot plant, die Unity-Stiftversion Ende 2020 mit einem möglichen Start für Ende des Jahres einzureichen.so werden wir sehen. Das auf Autonomy-Pumpen basierende System soll folgen, möglicherweise im Jahr 2023.
Beta Bionics iLet : Viele freuen sich über die „FDA-Durchbruchgerätekennzeichnung“ erhalten von diesem Technologieunternehmen mit geschlossenem Regelkreis im Dezember 2019, aber wir sind noch mindestens ein oder zwei Jahre von der Markteinführung dieses Produkts entfernt. Wir erwarten, dass eine Nur-Insulin-Version verfügbar sein wird, bevor wir schließlich zum Produkt gelangenDual-Hormon-Version mit Insulin und Glucagon in der Pumpe. Siehe DiabetesMine University 2019 Vorschau des Beta Bionics Systems hier .
Natürlich bedeuten alle oben genannten Innovationen nichts, wenn sich die Leute sie nicht leisten oder in die Hände bekommen können. Wir sehen dankbar schrittweise Fortschritte bei der Erschwinglichkeit aber bis 2020 und darüber hinaus ist es noch ein langer Weg.
Wir von der Mine nennen uns gerne "skeptische Optimisten", also hoffen wir, dass dieses Jahr bedeutende Fortschritte bringen kann, die so vielen Menschen mit Behinderung wie möglich zugänglich sind.